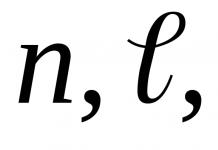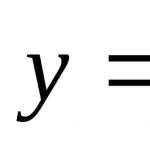Тема урока: Фосфор. Строение атома, аллотропия, свойства белого и красного фосфора, их применение. Основные соединения: оксид фосфора (V), ортофосфорная кислота и фосфаты. Фосфорные удобрения.
ДОШ № 112, Трубчанинова Н. И.,
урок химии 9 класс

- Изучить свойства фосфора, особенности строения его атома, аллотропию, физические и химические свойства простого вещества, познакомиться с основными соединениями фосфора, их свойствами и применением.
- Развивать умения анализировать, выделять главное, устанавливать причинно-следственные связи, исходя из строения и свойств, умение владеть химической терминологией, четко формулировать и высказывать мысли.
- Привить интерес к предмету. Показать важность знания химии в повседневной жизни.

Опорные понятия
Перед началом урока проверьте себя!
Что означают следующие понятия?
Если вы не знаете, то найдите определения и выпишите в тетрадь.
- Аллотропия.
- Аллотропные модификации.
- Неметаллические свойства.
- Окислитель.
- Восстановитель.
- Кислотный оксид.

Фосфор: положение в ПСХЭ и строение атома.
Положение в ПСХЭ
N = 15, A r (P) = 31
3 период, V-А группа.
р -элемент, неметалл
15 Р) 2) 8) 5 1s 2 s 2 2p 6 3s 2 3p 3

Аллотропия фосфора
Белый фосфор
P 4 Тетраэдрическое строение.
Желтый фосфор
ρ = 1, 83 г/см 3
(неочищенный белый фосфор)
Красный фосфор
Белое мягкое вещество.
Черный фосфор
Имеет молекулярную кристаллическую решетку
P n – полимер со сложной структурой.
Кристаллическое вещество пурпурно-красного цвета, имеет металлический блеск.
Т пл = 43,1 °С
Черное кристаллическое вещество с металлическим блеском.
Более термодинамически стабильная модификация, чем белый Р. Активность ниже, чем у белого Р.
Т кип = 280 °С
Наиболее стабильная аллотропная модификация.
Ядовит, огнеопасен.

Аллотропия фосфора
Белый фосфор
Желтый фосфор
Плохо растворим в воде, легко – в органических растворителях.
(неочищенный белый фосфор)
Красный фосфор
ρ = 1, 823 г/см 3
Окисляется кислородом воздуха и светится (бледно-зеленое свечение) – явление хемилюминесценции. (см. Приложение 2)
Плохо растворим в воде и в органических растворителях.
Черный фосфор
Не растворим в воде и в органических растворителях.
Т пл = 44,1 °С
См. Приложение 1, 3
Очень хорошо проводит электрический ток.
Т пл = 1000 °С (при повышенном давлении)

Аллотропия фосфора
Белый фосфор
Желтый фосфор
Ядовит, вызывает ожоги кожи
(неочищенный белый фосфор)
Под действием света, при повышении температуры переходит в красный фосфор.
Красный фосфор
Черный фосфор
Не самовоспламеняется.
Менее ядовит.
При повышении давлении переходит в металлическую фазу.

Нахождение в природе
- В земной коре ~ 0,08 % фосфора.
- В составе минералов – апатитов 3Са 3 (PO 4) 2 ∙CaF 2 , фосфатов Са 3 (PO 4) 2 , фосфоритов.
- В организме человека – в составе белков.
- Кости человека и зубная эмаль состоят из гидроксиапатита кальция.
- Фосфор – биогенный элемент, входит в состав нуклеотидов, нуклеиновых кислот, фосфолипидов, ферментов, коферментов и др.
Токсичность
- Красный фосфор – практически нетоксичен.
- Белый фосфор – очень ядовит, растворим в липидах, вызывает ожоги кожи. Смертельная доза – 50 – 150 мг.

Получение
1. Восстановление апатитов и фосфоритов.
Са 3 (PO 4) 2 + 10С + 6SiO 2 → P 4 + 10CO +6CaSiO 3
2. Восстановление других соединений, содержащих фосфор.
4HPO 3 + 12C → 4P + 2H 2 + 12CO

Химические свойства
I. P – окислитель.
1.1. Реакции с металлами – образование фосфидов.
2P + 3Ca → Ca 3 P 2 – фосфид кальция (см.Приложение 4)
2P + 3Mg → Mg 3 P 2 – фосфид магния
Фосфиды разлагаются с образованием газа фосфина – PH 3 (см.Приложение 5) :
Mg 3 P 2 + 3H 2 SO 4(р) → 2PH 3 + 3 MgSO 4

Химические свойства
II. P – восстановитель.
2.1. С кислородом – образование оксидов (см.Приложение 6).
4P + 3О 2 → 2P 2 O 3
4P + 5О 2 → 2P 2 O 5
2.2. С другими неметаллами – образование сульфидов, галогенидов.
2P + 3S → P 2 S 3
2P + Сl 2 → 2PCl 3
Не взаимодействует с водородом.

Химические свойства
II. P – восстановитель.
2.3. Реакции с сильными окислителями – окисляется до H 3 PO 4
2P + 5H 2 SО 4 → 2H 3 PO 4 + 5SO 2 + 2H 2 O
Реакция с бертолетовой солью KClO 3 – происходит при поджигании спичек:
6P + 5 KClO 3 → 5 KCl + 3P 2 O 5

Применение фосфора
Основное свойство – горючесть.
- Производство спичек (находится на боковой поверхности коробка, при трении головки, в состав которой входит KClO 3 и S, происходит воспламенение.
- Производство взрывчатых веществ, зажигательных смесей, топлив
- Производство удобрений

P 2 O 5 , реальная формула – P 4 H 10
Физические свойства
Белый гигроскопичный порошок.
Получение
1. Горение фосфора в избытке воздуха или кислорода.
4P + 5О 2 → 2P 2 O 5
Химические свойства
Кислотный оксид – свойства типичные для кислотного оксида: реагирует с металлами, основными оксидами, основаниями с образованием солей – фосфатов.

Оксид фосфора(V) – фосфорный ангидрид
1.1. Особо реагирует с водой
На холоду: P 2 O 5 + H 2 O → 2HPO 3 метафосфорная кислота.
При нагревании: P 2 O 5 + 3H 2 O → 2H 3 PO 4 ортофосфорная кислота.
При дальнейшем нагревании: 2H 3 PO 4 → H 2 O + H 4 P 2 O 7 пирофосфорная кислота
Применение
- Осушитель газов и жидкостей.
- Промежуточной продукт в получении ортофосфорной кислоты.
- В органическом синтезе – в реакциях дегидратации и конденсации.

Ортофосфорная кислота
H 3 PO 4
Физические свойства
Бесцветное гигроскопичное твердое вещество,
Хорошо растворимо в воде.
Получение
1. Взаимодействие оксида фосфора(V) с водой при нагревании.
P 2 O 5 + 3H 2 O → 2H 3 PO 4
2. Взаимодействие ортофосфата кальция с серной кислотой при нагревании.
Са 3 (PO 4) 2 + 3H 2 SO 4 → 3CaSO 4 + 2 H 3 PO 4
3. Взаимодействие фосфора с концентрированной азотной кислотой.
3P + 5HNО 3 + 2H 2 O → 3H 3 PO 4 + 5NO

Ортофосфорная кислота
Химические свойства
I. Общие свойства кислот
1.1. Диссоциация.
Водный раствор кислоты изменяет окраску индикаторов. Диссоциация протекает в 3 стадии.
H 3 PO 4 ⇄ H + + H 2 PO 4 - - дигидрофосфат-ион
H 2 PO 4 - ⇄ H + + HPO 4 2- - гидрофосфат-ион
HPO 4 2- ⇄ H + + PO 4 3- - - ортофосфат-ион
1.2. С металлами, расположенными в ряду напряжений до водорода
3Mg + 2H 3 PO 4 →Mg 3 (PO4) 2 + 3H 2
1.3. C основаниями и аммиаком
Если кислота взята в избытке – образуются кислые соли:

Ортофосфорная кислота
H 3 PO 4 + 3NaOH → Na 3 PO 4 + 3H 2 O
H 3 PO 4 + 2NH 3 →(NH4) 2 HPO 4
H 3 PO 4 + NaOH → NaH 2 PO 4 + H 2 O
1.4. C основными оксидами
3CaO + H 3 PO 4 → Са 3 (PO 4) 2 + 3H 2 O
1.5. C cолями слабых кислот
2H 3 PO 4 + 3Na 2 СO 3 → 2 Na 3 PO 4 + 3СО 2 + 3H 2 O
II. Cпецифические свойства
2.1. Переход в метафосфорную кислоту при нагревании.
2H 3 PO 4 → H 2 O + H 4 P 2 O 7 – пирофосфорная кислота
H 4 P 2 O 7 → 2HPO 3 + H 2 O – метафосфорная кислота

Ортофосфорная кислота
2.2. Качественная реакция на ортофосфат-ион – PO 4 3-
Реакция с раствором нитрата серебра(І), образует фосфат серебра - появляется желтый осадок (см. Приложение 7).
H 3 PO 4 + 3AgNO 3 → Ag 3 PO 4 ↓ + 3HNO 3
желтый осадок
Применение
- Производство минеральных удобрений.
- При пайке для удаления ржавчины.
- Входит в состав фреонов-хладоагентов в промышленных морозильных установках.
- Пищевая добавка E338, регулятор кислотности в напитках.

- 1. Прочитать параграфы 29, 30.
- 2. Выполнить задание письменно: 1, 2, 3 (с.110)

Приложение 1 Сравнение температуры воспламенения белого и красного фосфора

Приложение 2 Свечение белого фосфора

Приложение 3 Превращение красного фосфора в белый

Приложение 4 Получение фосфида кальция из простых веществ

Приложение 5 Гидролиз фосфида кальция

Приложение 6 Горение белого фосфора под водой

Приложение 7 Качественная реакция на ортофосфат-ион
1Фото
2. Аллотропия - существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам - так называемых аллотропных модификаций или форм.
Белый фосфор- желтовато-белое вещество (из-за примесей, по мягкости напоминает воск. Очень активное вещество; а светится, потому что уже при комнатной температуре окисляется кислородом из воздуха. Очень ядовитые и вонючие вещество.
Жёлтый фрсфор - то просто неочищенный белый фрсфор. Цвет - от желтого до коричневого. Так же активен, так же, как и белый фософр, на воздухе самовоспламеняется.
Красный фосфор - менее активное вещество, чем белый или желтый фосфор, меньше растворим в воде, на воздухе не самовоспламеняется и не светится. Менее ядовит.
Чёрный фосфор - чёрное вещество с металлическим блеском, на ощупь - жирный, внешне очень похож на графит. Чёрный фосфор даже проводит электрический ток, что обычно характерно для металлов. При определенном давлении он может переходить в модификацию, которую так и называют - металлический фосфор.
3. Самым распространенным является белый фосфор - он обладает воскообразной структурой и высокой токсичностью. Температура плавления данного вещества составляет сорок четыре градуса по Цельсию, а кипения - двести восемьдесят градусов. При трении данного материала он очень быстро возгорается, поэтому режут его, только поместив в водную среду. Если на протяжении длительного времени нагревать его при температуре двести пятьдесят градусов по шкале Цельсия, он превращается в красный фосфор. Это вещество представлено в виде порошка буро-красного цвета. Красный фосфор, в отличие от белого, не является ядовитым. Самой устойчивой формой существования данного элемента можно назвать черный фосфор, который по некоторым внешним признакам похож на металл: имеет своеобразный блеск, обладает высокой твердостью, электро- и теплопроводностью.
4. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора. 1)Фосфор легко окисляется кислородом.
2)Взаимодействует со многими простыми веществами - галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства, с металлами - окислитель, образует фосфиды.
3)Сильные окислители превращают фосфор в фосфорную кислоту.
4) Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:8P+12H2O➡5PH3+3H3PO4.
5. Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
2Ca3+(PO4)2+10C+6SiO2➡P4+10CO+6CaSi3.
6. Красный фосфор - основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
7. Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапати. Обмен фосфорных соединений регулируется гормонами и витамином D. При недостатке фосфора в организме развиваются различные заболевания костей.
Введение
Фосфор (лат. Phosphorus) P - химический элемент V группы периодической системы Менделеева атомный номер 15, атомная масса 30,973762(4). Рассмотрим строение атома фосфора. На наружном энергетическом уровне атома фосфора находятся пять электронов. Графически это выглядит так:
1s 2 2s 2 2p 6 3s 2 3p 3 3d 0

В 1699 г. гамбургский алхимик X. Бранд в поисках «философского камня», якобы способного превратить неблагородные металлы в золото, при выпаривании мочи с углём и песком выделил белое воскообразное вещество, способное светиться.
Название «фосфор» происходит от греч. «phos» - свет и «phoros» - несущий. В России термин «фосфор» введён в 1746 г. М.В. Ломоносовым.
К основным соединениям фосфора относят оксиды, кислоты и их соли (фосфаты, дигидрофосфаты, гидрофосфаты, фосфиды, фосфиты).
Очень много веществ, содержащих фосфор, содержатся в удобрениях. Такие удобрения называют фосфорными.
Фосфор как элемент и как простое вещество
Фосфор в природе
Фосфор относится к числу распространенных элементов. Общее содержание в земной коре составляет около 0,08%. Вследствие лёгкой окисляемости фосфор в природе встречается только в виде соединений. Главными минералами фосфора являются фосфориты и апатиты, из последних наиболее распространён фторапатит 3Ca 3 (PO 4) 2 * CaF 2 . Фосфориты широко распространены на Урале, в Поволжье, Сибири, Казахстане, Эстонии, Беларуси. Самые большие залежи апатитов находятся на Кольском полуострове.
Фосфор - необходимый элемент живых организмов. Он присутствует в костях, мышцах, в мозговой ткани и нервах. Из фосфора построены молекулы АТФ - аденозинтрифосфорной кислоты (АТФ - собиратель и носитель энергии). В организме взрослого человека содержится в среднем около 4,5 кг фосфора, в основном в соединении с кальцием.
Фосфор содержится также в растениях.
Природный фосфор состоит лишь из одного стабильного изотопа 31 Р. В наши дни известно шесть радиоактивных изотопов фосфора.
Физические свойства
Фосфор имеет несколько аллотропных модификаций - белый, красный, чёрный, коричневый, фиолетовый фосфор и др. Первые три из названных наиболее изучены.
Белый фосфор - бесцветное, с желтоватым оттенком кристаллическое вещество, светящееся в темноте. Его плотность 1,83 г/см 3 . Не растворяется в воде, хорошо растворяется в сероуглероде. Имеет характерный чесночный запах. Температура плавления 44°С, температура самовоспламенения 40°С. Чтобы защитить белый фосфор от окисления, его хранят под водой в темноте (на свету идёт превращение в красный фосфор). На холоде белый фосфор хрупок, при температурах выше 15°С становится мягким и режется ножом.
Молекулы белого фосфора имеют кристаллическую решётку, в узлах которой находятся молекулы Р 4 , имеющие форму тетраэдра.
Каждый атом фосфора связан тремя?-связями с другими тремя атомами.
Белый фосфор ядовит и даёт труднозаживающие ожоги.
Красный фосфор - порошкообразное вещество тёмно-красного цвета без запаха, в воде и сероуглероде не растворяется, не светится. Температура воспламенения 260°С, плотность 2,3 г/см 3 . Красный фосфор представляет собой смесь нескольких аллотропных модификаций, отличающихся цветом (от алого до фиолетового). Свойства красного фосфора зависят от условий его получения. Не ядовит.
Чёрный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Плотность 2,7 г/см 3 .
Красный и чёрный фосфоры имеют атомную кристаллическую решётку.
Химические свойства
Фосфор - неметалл. В соединениях он обычно проявляет степень окисления +5, реже - +3 и -3 (только в фосфидах).
Реакции с белым фосфором идут легче, чем с красным.
I. Взаимодействие с простыми веществами.
1. Взаимодействие с галогенами:
2P + 3Cl 2 = 2PCl 3 (хлорид фосфора (III)),
PCl 3 + Cl 2 = PCl 5 (хлорид фосфора (V)).
2. Взаимодействие с нематаллами:
2P + 3S = P 2 S 3 (сульфид фосфора (III).
3. Взаимодействие с металлами:
2P + 3Ca = Ca 3 P 2 (фосфид кальция).
4. Взаимодействие с кислородом:
4P + 5O 2 = 2P 2 O 5 (оксид фосфора (V), фосфорный ангидрид).
II. Взаимодействие со сложными веществами.
3P + 5HNO 3 + 2H 2 O = 3H 3 PO 4 + 5NO^.
Получение
Фосфор получают из измельченных фосфоритов и апатитов, последние смешиваются с углем и песком и прокаливаются в печах при 1500°С:
2Ca 3 (PO 4) 2 + 10C + 6SiO 2 6CaSiO 3 + P 4 ^ + 10CO^.
Фосфор выделяется в виде паров, которые конденсируются в приёмнике под водой, при этом образуется белый фосфор.
При нагревании до 250-300°С без доступа воздуха белый фосфор превращается в красный.
Чёрный фосфор получается при длительном нагревании белого фосфора при очень большом давлении (200°С и 1200 МПа).
Применение
Красный фосфор применяется при изготовлении спичек (см. рисунок). Он входит в состав смеси, наносимой на боковую поверхность спичечного коробка. Основным компонентом состава головки спички является бертолетова соль KClO 3 . От трения головки спички о намазку коробка частицы фосфора на воздухе воспламеняются. В результате реакции окисления фосфора выделяется тепло, приводящее к разложению бертолетовой соли.

Образующийся кислород способствует воспламенению головки спички.
Фосфор используют в металлургии. Он применяется для получения проводников и входит в состав некоторых металлических материалов, например оловянных бронз.
Также фосфор используют при производстве фосфорной кислоты и ядохимикатов (дихлофос, хлорофос и др.).
Белый фосфор используют для создания дымовых завес, так как при его горении образуется белый дым.
Описание презентации по отдельным слайдам:
1 слайд
Описание слайда:
Фосфор, строение атома, аллотропия, химические свойства фосфора. Оксид фосфора(V)
2 слайд
Описание слайда:
3 слайд
Описание слайда:
1. Изучить физические и химические свойства фосфора, оксида фосфора. Закрепить понятие аллотропии на примере аллотропных модификаций фосфора. 3. Развивать интерес к предмету, формирование диалектико-материалистического мировоззрения учащихся, рассматривая круговорот фосфора в природе. 2. Способствовать развитию у учащихся умения анализировать, обобщать, систематизировать полученные знания.
4 слайд
Описание слайда:
1 Открытие фосфора(1669год –немецкий химик Х. Бранд). 2. Строение атома фосфора. 3. Нахождение в природе. 4. Физические свойства. Аллотропные модификации фосфора. 5. Химические свойства фосфора. Окислительно-восстановительная двойственность. 6. Оксид фосфора(V), физические и химические свойства. 7. Биологическое значение фосфора. Круговорот фосфора в природе. Применение фосфора и его соединений.
5 слайд
Описание слайда:
Фосфор (Phosphorus, от греч. Phoros – несущий свет). Бывший немецкий солдат, а затем алхимик Хёниг Бранд решил разбогатеть. Он бродил по городу Гамбургу в поисках способа поправить свои дела, и в пивной познакомился с алхимиком, который поведал ему, что существует некий "философский камень", превращающий железо и свинец в золото. А искать этот камень надо в человеческом теле и в том, что из него исходит, например в моче... Потрясенный услышанным, Бранд тайно собирал в солдатских казармах этот "человеческий продукт" и порциями его выпаривал. Сухие остатки он объединил и, прокаливая их с углем, внезапно увидел в сосуде белый дым, светящийся в темноте. Так в 1669 году был получен белый фосфор - первый неметалл, открытие которого задокументировано и имеет определенную дату.
6 слайд
Описание слайда:
7 слайд
Описание слайда:
Фосфор - один из наиболее распространённых элементов в земной коре (0,093% по массе).В свободном состоянии в природе фосфор не встречается из-за высокой химической активности. В связанном виде он входит в состав около 200 минералов, главным образом апатитов Ca3(PO4)2*CaCl2 (хлорапатит), Ca3(PO4)2*CaF2 (фторапатит), а также фосфоритов Ca3(PO4)2. Большие запасы апатитов находятся на Кольском полуострове. Фосфор входит в состав растительных и животных белков. Содержание фосфора в тканях мозга составляет 0,38%, в мышцах 0,27%. фторапатит фосфорит хлорапатит
8 слайд
Описание слайда:
Черный фосфор Красный фосфор Белый фосфор Фосфор образует несколько аллотропных модификаций. Главные из них: белый, красный и черный фосфор. Белый фосфор –кристаллический порошок, имеет молекулярную кристаллическую решетку. Он не растворяется в воде, но растворяется в органических растворителях, летуч. Белый фосфор – сильный яд. При обычных условиях окисляется кислородом воздуха, окисление фосфора сопровождается свечением, которое хорошо заметно в темноте. Красный фосфор- порошок темно – красного цвета, он не ядовит, нелетуч. Взаимодействует с кислородом только при поджигании. Имеет атомную кристаллическую решетку. При давлении12∙108 Па переходит в черный фосфор. Черный фосфор образуется из белого при высоком давлении. По внешнему виду он похож на графит, имеет атомную кристаллическую решетку, обладает полупроводниковыми свойствами.
9 слайд
Описание слайда:
Химические свойства фосфора В химических реакциях фосфор проявляет окислительно-восстановительную двойственность. Фосфор взаимодействует с металлами, галогенами, серой, кислородом. (Данные уравнения реакций будут предложены к выполнению учащимися в домашнем задании) С солями –окислителями фосфор реагирует с сильным взрывом, что может привести к несчастному случаю, его нельзя смешивать с бертолетовой солью: 6Р +5KCIO3→ 3 P2O5 +5KCI Эта реакция используется в производстве спичек. Составить схемы электронного баланса данных реакций. 2P0+3Ca0=Ca3+2P2–3 окислитель восстановитель 4P0+5O20=2P2+5O5–2 восстановитель окислитель окислитель восстановитель Р+Са→Ca3P2 Р+О2→P2O5 окислитель восстановитель Р+Са→Ca3P2 Р+О2→P2O5 P+3e–®P–3 2 Ca-2e–®Ca+2 3 P0-5e–®P+5 4 O20+4e–®2O–2 5
10 слайд
Описание слайда:
Оксид фосфора (V) Р2О5 –белое кристаллическое веществ. Он не может быть получен дегидратацией фосфорной кислоты из-за высокой экзотермичности его реакции с водой. На этом основано его практическое применение как осушителя. Взаимодействует с водой при нагревании,образуя ортофосфорную кислоту. Оксид фосфора (V) Р2О5 Сделайте сами вывод о характере этого оксида,выберите уравнения возможных реакций, характерных для него: Оксид фосфора (V) реагирует с: а)водой, б)гидрооксидом калия в)оксидом углерода(ΙV) г)железом д)оксидом бария Уравнения возможных реакций составьте в тетради.
11 слайд
Описание слайда:
Соединения фосфора- обязательная составляющая растений, животных, человека. В растениях фосфор содержится главным образом в семенах, плодах: В организме человека и животных- в скелете,мышечной,нервной ткани.
12 слайд
Описание слайда:
Растения поглощают необходимый им фосфор из почвы. Животные получают его с растительной пищей.После отмирания растений и животных органические фосфоросодержащие соединения превращаются в неорганические –фосфаты под воздействием фосфоробактерий. Недостаток фосфора в почве не восполняется естественным путем, поэтому необходимо вносить фосфоросодержащие удобрения в почву.
13 слайд
Описание слайда:
14 слайд
Описание слайда:
А1 Электронная конфигурация 1S22S22P63S23P6 соответствует частице: 1) Р+3 2) Р-3 3) Р+5 4) N-3
15 слайд
Описание слайда:
А2 С какими из перечисленных веществ не реагирует оксид фосфора (V): вода оксид кальция гидроксид натрия 4) оксид серы (VΙ)
16 слайд
Описание слайда:
А3 Какие из приведенных суждений верны: А Фосфор образует несколько аллотропных модификаций: белый, красный и черный Б Все аллотропные модификации фосфора имеют атомные кристаллические решетки 2) Верно только Б 3) Верны оба утверждения 4) Оба утверждения неверны Верно только А
17 слайд
В Парижской библиотеке хранится манускрипт по алхимии, в котором описано открытие фосфора . Если верить документу, выделить элемент в чистом виде впервые удалось Алхид Бахилу.
Он жил в 12-ом веке. Фосфор мужчина получил, перегоняя мочу с известью и . Алхимик назвал светящееся вещество эскарбуклем. Современное имя элементу дал Хеннинг Бранд.
Он соединил греческие слова «свет» и «несу». Немец выделил белый фосфор в 1669-ом году, задокументировав свою заслугу, выступив перед ученым сообществом.
Хеннинг Бранд, как и Алхид Бахил, воспользовался выпаренной мочой, но нагревал ее с белым песком. В 17-ом веке, да и в 12-ом, свечение полученного вещества казалось чудом. У современников на физические свойства фосфора иной взгляд.
Физические и химические свойства фосфора
Элемент фосфор светится из-за процессов окисления. Взаимодействие с кислородом проходит быстро, возможно самовоспламенение.
Скорое и обильное высвобождение химической энергии приводит к ее переходу в энергию света. Процесс проходит даже при комнатной температуре.
Вот и секрет сияния фосфора. Кислород проще всего реагирует с белой модификацией элемента. Ее можно перепутать с воском, свечным парафином. Плавится вещество уже при 44-х градусах Цельсия.
Свойства фосфора белого цвета отличаются от свойств других модификаций элемента. Они, к примеру, не токсичны.
Бесцветный же фосфор ядовит, нерастворим в воде. Ей, как правило, и блокируют окисление порошка. Не вступая в реакцию с водой, белый фосфор легко растворяется органике, к примеру, сероуглероде.
В первой модификации вещество фосфор наименее плотное. На кубический метр приходится лишь 1 800 граммов. При этом, смертельной дозой для человека является всего 0,1 грамм.
Еще ядовитее желтый фосфор . По-сути, это разновидность белого, но не очищенная. Плотность вещества та же, воспламеняемость тоже.

Температура плавления чуть ниже – 34 градуса. Закипает элемент при 280-ти по шкале Цельсия. За счет загрязнений, при горении выделяется густой дым. С водой желтый фосфор, как и белый, в реакцию не вступает.
Существует еще красный фосфор . Его впервые получили в 1847-ом году. Австрийский химик Шреттер нагрел белую модификацию элемента до 500-от градусов в атмосфере угарного газа.
Реакция проводилась в герметичной колбе. Полученный вид фосфора оказался термодинамически стабильным. Вещество растворяется разве что в некоторых расплавленных металлах.
Воспламениться атом фосфора может лишь при прогреве атмосферы до 250 градусов Цельсия. Альтернатива – активное трение, или сильный удар.
Цвет красного фосфора бывает не только алым, но и фиолетовым. Свечение отсутствует. Почти отсутствует и ядовитость. Токсичное действие красной модификации элемента минимально. Поэтому, именно алый фосфор широко используют в промышленности.
Предпоследняя модификация элемента – черная. Получена в 1914-ом году, является самой стабильной. У вещества металлический блеск. Поверхность черного фосфора лоснится, похожа на .
Модификация не поддается ни одному растворителю, воспламеняется лишь в атмосфере, прогретой до 400-от градусов. Масса фосфора черного наиболее велика, как и плотность. Вещество «рождается» из белого при давлении в 13 000 атмосфер.

Если довести давление до сверхвысокого, появляется последняя, металлическая модификация элемента. Ее плотность достигает почти 4-х граммов на кубический сантиметр. Формула фосфора не меняется, но преобразуется кристаллическая решетка. Она становится кубической. Вещество начинает проводить электрический ток.
Применение фосфора
Оксид фосфора служит дымообразующим средством. Воспламеняясь, желтая модификация элемента дает густую завесу, что пригождается в оборонной промышленности.
В частности, фосфор добавляют в трассирующие пуля. Оставляя за собой дымный след, они позволяют корректировать направление, точность посылов. «Дорожка» сохраняется на протяжении километра.
В военной промышленности фосфор нашел место, так же, как воспламенитель. В этой роли элемент выступает и в мирных целя. Так, красную модификации используют при изготовлении спичек. Смазкой в них служит пара фосфор-сера , то есть, сульфид 15-го элемента .
Хлорид фосфора нужен при производстве пластификаторов. Так называют добавки, увеличивающие пластичность пластмасс и прочих полимеров. Хлорид закупают и аграрии. Они примешивают вещество к инсектицидам.
Их применяют для уничтожения вредителей на полях, в частности, насекомых. Опрыскивают посадки и пестицидами. В них присутствует уже дуэт кальций-фосфор или же фосфиды .
Если насекомых с помощью фосфорных смесей убивают, то растения – взращивают. Так, пары азот-фосфор и калий-фосфор – завсегдатаи удобрений. 15-ый элемент питает насаждения, ускоряет их развитие, повышает урожайность. Фосфор необходим и человеку.
В костях, нуклеиновых цепочках, белках, его скрыто примерно 800 граммов. Не зря же элемент был впервые добыт путем перегонки мочи. Запасы организма требуют ежедневного пополнения в размере 1,2-1,5 граммов. Они поступают с морепродуктами, бобовыми, сырами и хлебом.
Кислоты фосфора добавляют в продукты и искусственным путем. Зачем? Разбавленная фосфорная кислота служит усилителем вкуса для сиропов, мармеладов и газированных напитков. Если в составе продукта указана Е338, речь идет о соединении с участием 15-го элемента таблицы Менделеева.

Применение фосфора природа не связала с его свечением. Человек же сделал упор именно на это свойство. Так, львиная доля запасов элемента идет на производство красок. Составы для машин еще и защищают их от коррозии. Изобретены краски для и глянцевых поверхностей. Есть варианты для дерева, бетона, пластика.
Без 15-го элемента не обходятся многие синтетические моющие средства. В них содержится магний. Фосфор связывает его ионы.
Иначе, эффективность составов снижается. Без 15-го элемента снижается и качество некоторых сталей. Их основа – железо. Фосфор – лишь .
Добавка увеличивает прочность сплава. В низколегированных сталях фосфор нужен для облегчения их обработки и увеличении сопротивляемости коррозии.
Добыча фосфора
В таблице Менделеева фосфор 15-ый, но по распространенности на Земле – 11-ый. Вещество не редко и за пределами планеты. Так, в метеоритах содержится от 0,02 до 0,94% фосфора. Он найден и в образцах грунта, взятых с Луны.
Земные представители элемента – 200 минерал, созданные природой на его основе. В чистом виде фосфор не встречается. Даже в литосфере он представлен ортофосватом, то есть, окислен до высшей степени.
Чтобы выделить чистый элемент промышленники работают с фосфатом кальция. Его получают из фосфоритов и втораппатитов. Это 2 минерала, наиболее богатые 15-ым элементом. После реакции восстановления, остается 100-процентный фосфор.
В качестве восстановителя выступает кокс, то есть углерод. Кальций, при этом, связывают песком. Все это специалисты проделывают в электропечах. То есть, процесс выделения фосфора относится к электротермическим.
Таково получение белого или желтого фосфора. Все зависит от степени очистки. Что нужно сделать, чтобы перевести продукт в красную, черную, металлическую модификации, описано в главе «Химические и физические свойства элемента».
Цена фосфора
Есть фирмы и магазины, специализирующиеся на поставках химического сырья. Фосфор, как правило, предлагают в упаковках по 500 граммов и килограмму. За красную модификацию весом в 1 000 граммов просят около 2 000 рублей.
Белый фосфор предлагают реже и по цене примерно на 30-40% дешевле. Черная и металлическая модификации дорогостоящие и реализуются, как правило на заказ через крупные предприятия-производители.