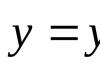Системы. Но данная величина не отражает настоящую возможность протекания реакции, ее скорость и механизм.
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм. Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные .
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны. Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени. Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
υ = ± dn / dt · V
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
υ = ± dC / dt ,
Единица измерения скорости реакции моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой , которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом: Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением :
υ = k·[A] a ·[B] b или
υ = k·C a A ·C b B
Здесь [ A ] и [ B ] (C A и C B )- концентрации реагентов,
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины k — это скорость реакции при единичных концентрациях. То есть, если концентрации веществ А и В равны 1, то υ = k .
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
- Реакция активируется термично, т.е. энергией теплового движения .
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k .
К сложным процессам закон действия масс применить нельзя. Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которя называется лимитирующей .
Каждая реакция имеет свой порядок . Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок . Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
υ = k ·[ A ] a ·[ B ] b
a – порядок по реагенту А
b — порядок по реагенту В
Общий порядок a + b = n
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения. Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Определим факторы, влияющие на скорость химической реакции υ.
Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс: υ = k [ A ] a ·[ B ] b
Очевидно, что с увеличением концентраций реагирующих веществ, υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами. Причем, важно учитывать порядок реакции: если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если по какому-либо реагенту n = 2 , то удвоение его концентрации приведет к росту скорости реакции в 2 2 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 3 2 = 9 раз.
1. Основные понятия и постулаты химической кинетики
Химическая кинетика - раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача ); 2) определение механизмов реакций по кинетическим кривым (обратная задача ).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
a A + b B + ...d D + e E + ...
скорость реакции определяется следующим образом:
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t - время; a , b , d , e - стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики - законом действующих масс :
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
![]() ,
,
где k - константа скорости (не зависящая от концентрации); x , y - некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции . Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями . Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A B + ...), бимолекулярные (A + B D + ...) и тримолекулярные (2A + B D + ...). Для элементарных реакций общий порядок равен молекулярности, а порядки по веществам равны коэффициентам в уравнении реакции.
ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr (г) 2NO (г) + Br 2(г) равна 1.6 . 10 -4 моль/(л. с). Чему равна скорость реакции и скорость расходования NOBr?
Решение . По определению, скорость реакции равна:
Моль/(л. с).
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
![]() моль/(л. с).
моль/(л. с).
Пример 1-2. В реакции 2-го порядка A + B D начальные концентрации веществ A и B равны, соответственно, 2.0 моль/л и 3.0 моль/л. Скорость реакции равна 1.2 . 10 -3 моль/(л. с) при [A] = 1.5 моль/л. Рассчитайте константу скорости и скорость реакции при [B] = 1.5 моль/л.
Решение . По закону действующих масс, в любой момент времени скорость реакции равна:
![]() .
.
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
Л/(моль. с).
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
Моль/(л. с).
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N 2 + 3/2 H 2 = NH 3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N 2 + 3/2 H 2 = NH 3 , если уравнение реакции записать в виде N 2 + 3H 2 = 2NH 3 ? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H 2 = HCl + H; б) 2NO + Cl 2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль. с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n -го порядка nA B выразите скорость образования B через суммарное давление.(ответ)
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль. с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI H 2 + I 2 имеет 2-й порядок с константой скорости k = 5.95 . 10 -6 л/(моль. с). Вычислите скорость реакции при давлении 1 атм и температуре 600 К. (ответ)
1-12. Скорость реакции 2-го порядка A + B D равна 2.7 . 10 -7 моль/(л. с) при концентрациях веществ A и B, соответственно, 3.0 . 10 -3 моль/л и 2.0 моль/л. Рассчитайте константу скорости.(ответ)
1-13. В реакции 2-го порядка A + B 2D начальные концентрации веществ A и B равны по 1.5 моль/л. Скорость реакции равна 2.0 . 10 -4 моль/(л. с) при [A] = 1.0 моль/л. Рассчитайте константу скорости и скорость реакции при [B] = 0.2 моль/л. (ответ)
1-14. В реакции 2-го порядка A + B 2D начальные концентрации веществ A и B равны, соответственно, 0.5 и 2.5 моль/л. Во сколько раз скорость реакции при [A] = 0.1 моль/л меньше начальной скорости? (ответ)
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
![]() ,
,
где [A] - концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A B скорость прямо пропорциональна концентрации:
![]() .
.
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A] 0 = a , текущая концентрация [A] = a - x (t ), где x (t ) - концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
![]() .
.
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2 . Он определяется уравнением x (t 1/2) = a /2 и равен
Реакции 2-го порядка. В реакциях типа A + B D + ... скорость прямо пропорциональна произведению концентраций:
![]() .
.
Начальные концентрации веществ: [A] 0 = a , [B] 0 = b ; текущие концентрации: [A] = a - x (t ), [B] = b - x (t ).
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b . Кинетическое уравнение имеет вид:
![]() .
.
Решение этого уравнения записывают в различных формах:
Период полураспада веществ A и B одинаков и равен:
2) Начальные концентрации веществ A и B различны: a
b
. Кинетическое
уравнение имеет вид:![]() .
.
Решение этого уравнения можно записать следующим образом:
Периоды полураспада веществ A и B различны: ![]() .
.
Реакции n-го порядка n A D + ... Кинетическое уравнение имеет вид:
![]() .
.
Решение кинетического уравнения:
 . (2.1)
. (2.1)
Период полураспада вещества A обратно пропорционален (n -1)-й степени начальной концентрации:
![]() . (2.2)
. (2.2)
Пример 2-1.
Период полураспада
радиоактивного изотопа 14 C - 5730 лет. При
археологических раскопках было найдено дерево,
содержание 14 C в котором составляет 72% от
нормального. Каков возраст дерева?
Решение.
Радиоактивный распад - реакция 1-го
порядка. Константа скорости равна:
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A] 0:
Пример 2-2.
Установлено, что реакция 2-го
порядка (один реагент) завершается на 75% за 92 мин
при исходной концентрации реагента 0.24 М. Какое
время потребуется, чтобы при тех же условиях
концентрация реагента достигла 0.16 М?
Решение.
Запишем два раза решение
кинетического уравнения для реакции 2-го порядка
с одним реагентом:
![]() ,
,
где, по условию, a = 0.24 M, t 1 = 92 мин, x 1 = 0.75 . 0.24 = 0.18 M, x 2 = 0.24 - 0.16 = 0.08 M. Поделим одно уравнение на другое:
Пример 2-3.
Для элементарной реакции n
A B обозначим
период полураспада A через t 1/2 , а время
распада A на 75% - через t 3/4 . Докажите, что
отношение t 3/4 / t 1/2 не зависит от
начальной концентрации, а определяется только
порядком реакции n
.Решение.
Запишем два раза решение
кинетического уравнения для реакции n
-го
порядка с одним реагентом:
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
![]() .
.
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
 .
.
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x , за которое степень превращения исходного вещества достигает x , не зависит от начальной концентрации. (ответ)2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, - 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, - 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO 2 Cl 2 = SO 2 + Cl 2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO 2 Cl 2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N 2 O 5(г) 4NO 2(г) + O 2(г)
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N 2 O 5 ? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 2B протекает в газовой фазе. Начальное давление равно p 0 (B отсутствует). Найдите зависимость общего давления от времени. Через какое время давление увеличится в 1.5 раза по сравнению с первоначальным? Какова степень протекания реакции к этому времени? (ответ)
2-9. Реакция второго порядка 2A B протекает в газовой фазе. Начальное давление равно p 0 (B отсутствует). Найдите зависимость общего давления от времени. Через какое время давление уменьшится в 1.5 раза по сравнению с первоначальным? Какова степень протекания реакции к этому времени? (ответ)
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций - первого, второго или третьего порядка - закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
2-12. Реакция
CH 3 CH 2 NO 2 + OH - H 2 O + CH 3 CHNO 2 -
имеет второй порядок и константу скорости k = 39.1 л/(моль. мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана?
2-13. Константа скорости рекомбинации ионов H + и ФГ - (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль. с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль. мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B P проводится в растворе с начальными концентрациями [A] 0 = 0.050 моль/л и [B] 0 = 0.080 моль/л. Через 1 ч концентрация вещества А уменьшилась до 0.020 моль/л. Рассчитайте константу скорости и периоды полураспада обоих веществ.
Согласно закону действия масс скорость простой реакции равна
Константа скорости
реакции
k
-
коэффициент
пропорциональности между скоростью
химической реакции и произведением
концентраций реагирующих веществ: .
Константа скорости численно равна
скорости химической реакции, когда
концентрации всех реагентов равны
единице: W=k
при C A =C B =1.
Если реакция А с В по своему механизму
сложная (в ней участвуют активные
промежуточные продукты, катализатор и
т. д.), подчиняется уравнению
.
Константа скорости численно равна
скорости химической реакции, когда
концентрации всех реагентов равны
единице: W=k
при C A =C B =1.
Если реакция А с В по своему механизму
сложная (в ней участвуют активные
промежуточные продукты, катализатор и
т. д.), подчиняется уравнению
 ,
то k
называют эффективной
константой скорости реакции;
IUPAC
рекомендует называть k
в этом случае коэффициентом
скорости реакции.
Нередко скорость сложной реакции не
подчиняется степенному уравнению, а
выражается иной зависимостью, например
v=k 1 C 1 C 2 (1+k 2 C 2) –1 .
Тогда k 1
и k 2
называют коэффициентами
в уравнении для скорости реакции.
,
то k
называют эффективной
константой скорости реакции;
IUPAC
рекомендует называть k
в этом случае коэффициентом
скорости реакции.
Нередко скорость сложной реакции не
подчиняется степенному уравнению, а
выражается иной зависимостью, например
v=k 1 C 1 C 2 (1+k 2 C 2) –1 .
Тогда k 1
и k 2
называют коэффициентами
в уравнении для скорости реакции.
Часто реакцию проводят в условиях, когда концентрации всех реагентов, кроме одного, взяты в избытке и в ходе опыта практически не меняются. В этом случае
 ,
,
а коэффициент
k набл =
k называют эффективной
или наблюдаемой
константой скорости реакции
при С B >>С A .
Для случая n A =1
такой коэффициент часто называют
коэффициентом скорости реакции
псевдопервого порядка. Константа
скорости реакции порядка
n
имеет размерность: (время) –1 (концентрация) –(n –1) .
Численное значение зависит от единиц,
выбранных для измерения времени и
концентрации.
называют эффективной
или наблюдаемой
константой скорости реакции
при С B >>С A .
Для случая n A =1
такой коэффициент часто называют
коэффициентом скорости реакции
псевдопервого порядка. Константа
скорости реакции порядка
n
имеет размерность: (время) –1 (концентрация) –(n –1) .
Численное значение зависит от единиц,
выбранных для измерения времени и
концентрации.
При вычислении константы скорости простой реакции необходимо учитывать два обстоятельства: помнить, по какому реагенту измеряется скорость реакции и чему равен стехиометрический коэффициент и порядок реакции по этому реагенту. Например, реакция 2,4,6-триалкилфеноксильного радикала с гидропероксидом протекает в две последовательные стадии:
PhО +ROOH→PhOH+RO 2
PhO +RO 2 →ROOPhO
Стехиометрическое уравнение – 2PhО +RООН=РhОН+ROОPhО, но поскольку первая стадия определяет скорость реакции, W ROOH =k и W PhO =2k.
Таким образом, здесь не совпадают коэффициенты в кинетическом и стехиометрическом уравнениях для феноксильного радикала: порядок реакции по PhO равен 1, а стехиометрический коэффициент для PhO равен 2.
Методы вычисления константы скорости химической реакции . По кинетической кривой. Если n= 1, то k=t –1 ln 10 lg (C Ao /C A). Если суммарный порядок реакции ‑ n, а порядок реакции по данному компоненту равен 1, и все реагенты, кроме А, взяты в избытке, то
 .
.
Для реакции А+В→продукты k находят из уравнения

При вычислении константы скорости по интегральной кинетической кривой в общем виде ставится задача по определению k в уравнении f(x)= –k`t (x ‑ относительная концентрация реагента).
Для реакции 1-го порядка f(x)=ln x, k`=k; для реакции 2-го порядка f(x)=x –1 –1, k=C o k и т.д. Из эксперимента получаем ряд значений (t 1 , x 1), (t 2 , x 2), …, (t n , x n). Прямая, проведенная в координатах f(x)–t, должна удовлетворять условию i =f(x i)+kt i , Σ i =0. Отсюда следует, что k= Σf(x i)/Σt i .
По периоду полупревращения. Период полупревращения однозначно связан с константой скорости и исходной концентрацией реагента, что позволяет вычислить k. Так, для реакции первого порядка k=ln 2/τ 1/2 , для реакции второго порядка k=C o –1 τ 1/2 и т.д.
По начальной скорости реакции . Поскольку в начальный момент времени расходование реагентов незначительно,
 и
и

По изменению скорости реакции во времени. Измерив концентрации реагентов в момент времени t` и t`` (С` и С``), можно вычислить среднюю скорость реакции и найти k, при ν=1 имеем
 ,
,
 ,
,
 .
.
Специальные методы обработки кинетических кривых. Если кинетика реакции регистрируется по изменению какого-либо физического свойства системы x (оптическая плотность, электрическая проводимость и т.д.), связанного с концентрацией реагирующего вещества С так, что при C=C o , x=x o , а при С=0, х=x ∞ , то k можно определить из кинетической кривой x(t) следующими методами:
Метод Гуггенгейма (для реакций первого порядка). Измеряют x i в момент t i и x 1 ` в момент t i + и т.д. Из графика lg (х i –х i `)–t i находят k:
lg (x i –x i `)=lg[(x o –x ∞)(1–e – k )]–0,43kt i .
Метод Мангельсдорфа (для реакций первого порядка). Измерения проводят как в методе Гуггенгейма, но график строят в координатах x i ` – x i:
x i `=x i e –k +x ∞ (1–e –k ),
наклон прямой равен e – k , отсечение на оси ординат равно х ∞ (1–e – k ).
Метод Розвери (для реакций второго порядка). Параметр х измеряют в моменты времени t 1 , t 2 , t 3 разделенные постоянным интервалом времени . Константу скорости находят из уравнения:
 .
.
Методические указания к лабораторной работе
По дисциплине ""Химия"" для студентов
Составитель В.С. Аксенов
Рецензент
Доктор химических наук, профессор Ф.Ф. Ниязи
Скорость химических реакций : Методические указания к лабораторной работе по дисциплине ""Химия"" / Курск. гос. техн. ун-т; Сост. В.С.Аксенов. Курск, 2003. 20 с.
Излагаются методические материалы по изучению темы ""Скорость химических реакций"", расчету скоростей в химических реакциях и выполнению лабораторной работы.
Предназначены для студентов всех специальностей, изучающих общую химию
Табл. 2. Ил. 2.
ИД № 06430 от 10.12.01.
Подписано в печать. Формат 60х84 1/16. Печать офсетная. Усл.печ.л. 1,16. Уч.-изд.л. 1,05. Тираж 50 экз. Заказ
Курский государственный технический университет.
Издательско-полиграфический центр Курского государственного технического университета. 305040 Курск, ул. 50 лет Октября, 94.
Контрольные вопросы по теме
1. Что такое скорость химической реакции? В каких единицах она измеряется?
2. Что такое истинная и средняя скорость реакции?
3. Что такое кинетическое уравнение реакции (закон действующих масс)?
4. Как записывается кинетическое уравнение для гомогенной реакции?
5. Каковы особенности гетерогенные реакций?
6. Что такое кинетический, диффузионный и смешанный контроль в гетерогенных реакциях?
7. Какие существуют формы записи для кинетических уравнений гетерогенных реакций?
8. Что такое константа скорости реакции? Какие условия проведения реакции влияют, а какие не влияют на величину константы скорости?
10 . Когда влияет давление на скорость химической реакции?
12 . Как влияет температура на скорость химической реакции? Приведите уравнение Вант-Гоффа.
13 . Что такое температурный коэффициент реакции?
14 . Что такое катализ? На какие параметры процесса действует катализатор?
Скорость химических реакций.
Кинетика ― учение о скорости различных процессов, в том числе химических реакций. Одним из основных понятий в химической кинетике является скорость реакции.
Скоростью химической реакции V называют изменение количества реагирующего вещества за единицу времени в единице реакционного пространства .
В гомогенной системе реакционным пространством служит объем сосуда, в котором протекает взаимодействие, а количество вещества в единице объёма называется концентрация С и выражается в моль/л .
Поэтому с случае гомогенного процесса, протекающего при постоянном объёме, скорость гомогенной химической реакции измеряется изменением концентрации какого-либо из реагирующих веществ за единицу времени .
Обычно время τ выражается в сек, поэтому размерность скорости реакции как правило,моль/л·сек . При химическом взаимодействии концентрация каждого из исходных веществ уменьшается во времени (С 2 <С 1 , ΔС<0) , а концентрация каждого из продуктов реакции возрастает (С 2 >С 1 , ΔС>0) . Изменение концентраций исходных веществ и продуктов реакции во времени приведено на рис.1. В химической кинетике различают среднюю и истинную (или мгновенную) скорость реакции. Средняя скорость v равна отношению ΔС/Δτ (ΔС = С 2 -С 1 , Δτ = τ 2 -τ 1 ) . Чтобы величина скорости была всегда положительной, перед дробью ставят знаки ""±"".
V = ± -–-
Δτ
Истинная скорость химической реакции V ист определяется пределом, к которому стремится отношение ΔС/Δτ при τ → 0, т.е. производной концентрации по времени:
V ист = ± -–-
dτ
Зависимость скорости реакции от концентрации реагентов. Необходимым условием для осуществления акта химического взаимодействия между молекулами должно быть их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходят тем чаще, чем больше этих молекул. Поэтому скорость химической реакции зависит от концентрации реагирующих веществ. По мере уменьшения концентрации исходных веществ во времени (рис.1, кривая 1) скорость реакции падает.
Количественно зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс , который в современной формулировке выглядит так:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции .
Для реакции а А + b В → m М + n N
математическое выражение закона действующих масс имеет вид:
V = k С А а ·С В b (1)
где V ― скорость реакции; С А и С В ― концентрации реагентов А и В; а , b ― стехиометрические коэффициенты в уравнении реакции; k ― коэффициент пропорциональности, называемый константой скорости химической реакции. Размерность константы скорости определяется величинами стехиометрических коэффициентов а и b и остается такой, чтобы скорость V имела размерность моль/л∙сек . Если нет точных данных, размерность k принимают сек ―1 . При С А = С В = 1 моль/л k численно равнаV . Выражение (1) называют также кинетическим уравнением реакции .
Константа скорости химической реакции k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Пример 1 . В реакционный сосуд объемом 2 л помещены 0,06 моль вещества А и 0,02 моль вещества В. При определенной температуре протекает реакция А + 2В = АВ 2 Найти значение константы скорости реакции при этой температуре, если при заданных концентрациях веществ А и В скорость реакции равна 6·10 ―7 моль/(л·сек) .
Решение: Зная количества реагирующих веществ и объем системы, найдем молярные концентрации реагентов:
С А = 0,06/2 = 0.03 = 3·10 ―2 моль/л ; С В = 0,02/2 = 0.01 = 10 ―2 моль/л
Запишем выражение кинетического уравнения, связывающего скорость реакции с концентрациями реагирующих веществ:
V = k С А ·С В 2
V 6.10 ―7
Отсюда: k = ----- = ------- = 0,2 л 2 /(моль) 2 ∙сек
С А ·С В 2 · 3·10 ―2 (10 ―2) 2
Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий, протекающих в газах или в разбавленных растворах. Сложные реакции могут быть совокупностью параллельно или последовательно протекающих процессов. Закон действующих масс справедлив для каждой отдельной стадии реакции, но не для всего взаимодействия в целом. Та стадия процесса, скорость которой минимальна, лимитирует скорость реакции в общем. Поэтому математическое выражение закона действующих масс, записанное для самой медленной (лимитирующей) стадии процесса, приложимо одновременно и ко всей реакции в целом.
Если в реакции участвуют два или более веществ, то скорость реакции может зависеть от концентрации только одного из них, участвующего в самой медленной стадии процесса и не зависеть от концентрации других.
Скорость гетерогенных химических реакций. Многие химические процессы, имеющие большое значение в технике, относятся к числу гетерогенных реакций. Один или несколько компонентов процесса находятся в конденсированной, обычно твердой фазе. Концентрации твердых веществ не записываются в кинетическое уравнение (закон действующих масс) . Условно эти концентрации принимают постоянными и равными 1. Это первая особенность гетерогенных реакций. Они идут на поверхности раздела фаз, которая и является их реакционным пространством. Поэтому второй особенностью кинетики этих реакций является влияние площади реакционной поверхности на скорость реакции. Так для реакции:
Fе 2 О 3(К) + 3СО (Г) → 2Fе + 3СО 2(Г)
кинетическое уравнение может быть записано в виде: V = k∙С 3 СО ∙S , где С СО ― молярная концентрация монооксида углерода СО (Г) , единственного газообразного компонента в реагирующих исходных веществах, S ― площадь поверхности, на которой идет реакция. Твердое вещество Fе 2 О 3(К) в кинетическое уравнение не записывается. Скорости гетерогенных химических реакций имеют размерность моль/л∙сек∙м 2
Однако в большинстве случаев площадь реакционной поверхности практически невозможно измерить и она непосредственно не фигурирует в кинетическом уравнении (законе действующих масс). Она
""запрятывается"" в константу скорости k и это учитывается в размерности константы скорости.
Пример 2 . Для реакции: Si (ТВ) + 2Н 2 О (Г) SiО 2(ТВ) + 2Н 2(Г) напишите выражение для кинетического уравнения.
Решение: Данная реакция гетерогенная, протекает на границе раздела фаз. Из реагирующих веществ вода участвует в реакции в газообразной форме, перед ней коэффициент в уравнении равен 2 (…+ 2Н 2 О (Г) ). Кремний (Si (ТВ) ) ― твердое вещество, поэтому его концентрацию не учитываем в кинетическом уравнении. Следовательно, кинетическое уравнение (закон действующих масс) для данной реакции может иметь вид: V = k·С 2 Н 2 О . Размерность константы скорости в этом случае л/моль∙сек∙м 2 .
В процессе реакции уменьшается концентрация реагента в зоне реакции C S по сравнению с его концентрацией в в объеме C V из-за расхода реагента. Поэтому скорость гетерогенной химической реакции зависит от скорости подвода реагентов в зону химической реакции ,
что является третьей особенностью этих реакций.
Наибольшее изменение концентрации реагента происходит в тонком слое около реакционной поверхности, называемом диффузионны ом слоем. Перенос вещества здесь происходит в основном за счет диффузии.
Если скорость диффузии много больше скорости реакции (V Д >> V ), то реагенты без проблем подаются в реакционное пространство, к поверхности, все законы влияния концентрации на скорость, описанные выше, соблюдаются. Для таких случаев есть выражение «кинетический контроль реакции ». Если скорости химической реакции и диффузии сопоставимы, имеет место смешанный контроль . И, наконец, когда скорость диффузии много меньше скорости реакции (V Д << V ) то говорят о диффузионном контроле реакции.
В этом случае может наблюдаться нулевой
порядок реакции по всем реагентам. Это
значит, что в координатахV
―
C
скорость
не зависит от концентраций реагентов,
а зависит от скорости диффузии, величины
поверхности и температуры, которые не
входят в кинетическое уравнение. Такое
явление может иметь место при реакции
на твердой поверхности в жидких средах
с высокой вязкостью. Однако большинство
гетерогенных реакций имеет порядок,
отличающийся от нулевого, нередко
дробный. На рис. 2 приведены графические
формы возможных зависимостей скорости
реакции от концентраций реагентов.
этом случае может наблюдаться нулевой
порядок реакции по всем реагентам. Это
значит, что в координатахV
―
C
скорость
не зависит от концентраций реагентов,
а зависит от скорости диффузии, величины
поверхности и температуры, которые не
входят в кинетическое уравнение. Такое
явление может иметь место при реакции
на твердой поверхности в жидких средах
с высокой вязкостью. Однако большинство
гетерогенных реакций имеет порядок,
отличающийся от нулевого, нередко
дробный. На рис. 2 приведены графические
формы возможных зависимостей скорости
реакции от концентраций реагентов.
Зависимость скорости реакций от давления в системе. В тех случаях, когда среди реагирующих веществ имеются газы, скорость реакций зависит от давления в системе. При повышении давления пропорционально возрастает число молекул газа в единице объема, что эквивалентно повышению концентрации данного газа.
Пример 3. Как изменится скорость реакции 2NО + О 2 → 2NО 2 при уменьшении объема замкнутой системы в два раза при постоянной температуре?
Решение. Уменьшение объема в замкнутой системе эквивалентно пропорциональному увеличению давления, так как, согласно закону Менделеева-Клайперона РW = νRТ. (Здесь W ― объем системы.)
Кинетическое уравнение данной реакции имеет вид: V = k С 2 NО ·С О 2
При уменьшении объема системы в два раза и связанным с этим повышении давления в два раза концентрации реагирующих веществ тоже повышаются в два раза: С" NО = 2С NО С" О 2 = 2С О 2
Новая скорость реакции:
V" = k С" NО 2 ·С" О 2 = k (2 С NО ) 2 ·(2С О 2 ) = 8 k С NО 2 ·С О 2 = 8V
Вывод. При уменьшении объема замкнутой системы в два раза при постоянной температуре скорость данной реакции повышается в 8 раз.
Зависимость константы скорости реакции от температуры . Большинство реакций ускоряется при нагревании. Температура действует непосредственно на константу скорости k . Пусть V 1 ― скорость реакции при температуре Т 1 , а V 2 ― скорость этой же реакции при температуре Т 2 (Т 1 <Т 2 ) . В таком случае имеет место эмпирическое правило Вант-Гоффа.

где γ – температурный коэффициент, показывающий во сколько раз повысится скорость реакции при повышении температуры на 10 0 С. Для большинства реакций при температурах, близких к комнатной, γ составляет величину 2-4.
Уравнение Вант-Гоффа широко используется, однако следует помнить, что оно эмпирическое приблизительное, его можно применять только для ориентировочных расчетов.
Пример 4. При 100 0 С некоторая реакция заканчивается за 20 мин. Принимая температурный коэффициент скорости реакции γ = 3,5, рассчитайте, через какое время закончится реакция при 60 0 С
Решение . Скорость реакции, как и скорость всякого процесса, обратно пропорциональна времени проведения процесса. Следовательно, V 2 /V 1 = τ 1 /τ 2 . Пусть Т 1 , V 1 и τ 1 ― параметры медленного (низкотемпературного) процесса, а Т 2 , V 2 и τ 2 ― параметры высокотемпературного процесса. Подставляем имеющиеся данные в уравнение Вант-Гоффа:
V 2 /V 1 = 3,5 (100 ― 60)/10 = (3,5) 4 = 150. Так как V 2 /V 1 = τ 1 /τ 2 = 150,
τ 1 /τ 2 = τ 1 /20 τ 1 = 150·20 = 3000 мин = 50 часов.
Одним из методов ускорения химической реакции является катализ , который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Как и при повышении температуры, при введении катализатора повышается константа скорости реакции . Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом резко повышается
Множитель k в кинетических уравнениях (1.3)- (1.8), показывающий, c какой скоростью идет процесс при концентрациях реагирующих веществ, равных единице, называется константой скорости химического процесса.
Наряду со скоростью константа скорости химического процесса является основным параметром в химической кинетике.
Константы скорости реакций различного порядка имеют неодинаковую размерность. Из уравнения (1.5) следует, что размерность константы скорости для реакции первого порядка t -1 ; из уравнения (1.7) – размерность константы скорости второго порядка c -1 t -1 ; константа скорости третьего порядка, как следует из уравнения (1.8), имеет размерность c -2 t -1 , где c -концентрация, t - время.
Концентрацию обычно измеряют в моль/л , а время в секундах (с ). Тогда размерность константы скорости первого порядка с -1 , второго – л.моль -1 с -1 , третьего – л 2 .моль -2 .с -1 .
Константа скорости реакции зависит от того, по какому соединению она измерена. Например, в реакции димеризации диоксида азота
скорость исчезновения NO 2 вдвое больше скорости появления N 2 O 4 .

Уравнение Аррениуса
Константа скорости химической реакции, как правило, резко возрастает с увеличением температуры. Обычно увеличение температуры реакционной смеси на 10°С приводит к возрастанию скорости реакции в 2-4 раза. Зависимость константы скорости реакции от температуры в большинстве случаев может быть описана уравнением Аррениуса
 ,
(1.9)
,
(1.9)
где E a - энергия активации;
R - универсальная газовая постоянная, равная 8.3 Дж/(моль.К),
А - предэкспоненциальный множитель - частотный фактор, имеющий размерность константы скорости.
Чем больше величина E a , тем быстрее растет скорость реакции с температурой. Если реакции простые, величина E a показывает, какой минимальной избыточной энергией в расчете на 1 моль должны обладать реагирующие частицы, чтобы они могли вступить в реакцию. Частицы, энергия которых больше или равна E a , называются активными.
Для сложных реакций, состоящих из нескольких стадий, параметр E a в уравнении (1.9) не всегда имеет простой физический смысл и часто является некоторой функцией энергии активации отдельных стадий. Тем не менее, и в этом случае параметр E a принято считать энергией активации, хотя правильнее называть его эффективной или эмпирической энергией активации.
Параметры Е а и А могут быть определены из зависимости константы скорости реакции от температуры с помощью уравнения (1.9), записанного в виде:
![]() (1.10)
(1.10)
Из графика зависимости ln k от 1/Т (рис. 1.2) легко находят ln А и E а / R , а из них А и E а. В принципе для определения E а и А достаточно знать константы скорости k 1 и k 2 при двух значениях температуры Т 1 и Т 2

Рисунок 1.2- Аррениусовская зависимость скорости реакции от температуры

Тогда, согласно уравнению (1.10)
Такое определение Е a , как правило, не обеспечивает достаточной точности, и рекомендуется определение энергии активации проводить не менее чем по четырем значениям константы скорости при четырех различных температурах в интервале не менее 30-40 °С.
Нулевой порядок реакции
При проведении гомогенного нитрования бензола, толуола, этилбензола большим избытком азотной кислоты (5 молей НNО 3 на 0.1 моля нитруемого соединения) было обнаружено, что скорость нитрования остается неизменной, пока все нитруемое соединение не прореагирует.
Следовательно, реакция имеет нулевой порядок:
Величина константы скорости нитрования бензола, толуола и этилбензола в этих условиях одинакова и не зависит от концентрации нитруемого соединения. Это объясняется тем, что скорость образования нитроний-катиона в процессе автопротолиза азотной кислоты ниже скорости нитрования ароматического соединения:

а поскольку азотная кислота присутствует в большом избытке, ее концентрация прак-тически не изменяется в ходе реакции.