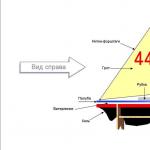
Система структурно и функционально связанных трансмембранных белков и переносчиков электронов. Она позволяет запасти энергию, выделяющуюся в ходе окисления NAD*H и ФАДН2 молекулярным кислородом в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи,сопряжённого с перекачкой протонов через мембрану. Транспортная цепь у эукариот локализована на внутренней мембране митохондрий. В дыхат.цепи 4 мультиферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
1ый- КоА-оксидоредуктаза.
1.Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2ой-ФАД-зависимые дегидрогеназы.
1.Восстановление ФАД 3ий-цитохром с-оксидоредуктаза.
2.Принимает электроны от коэнзима Q и передает их на цитохром с.
3.Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4ый-цитохром с-кислород оксидоредуктаза.
1.Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2.Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. Все атомы водорода, отщепленные дегидрогеназами от субстратов в аэробных условиях, достигают внутренней мембраны митохондрий в составе НАДН или ФАДН2.
Электроны по мере передвижения теряют энергию->энергия тратиться комплексами на перекачку протонов Н.Перенос ионов Н происходит в строго определённых участках->участках сопряжения.Результат: происходит наработка АТФ: ионы H+ теряют свою энергию, проходя через АТФ-синтазу.Часть этой энергии тратится на синтез АТФ. Другая часть рассеивается в виде тепла.
Дыхательная цепь митохондрий состоит из 5 мультифер-ментных комплексов, субъединицы которых кодируются как ядерными, так и митохондриальными генами. В переноске электронов участвуют коэнзим Q10 и цитохром с. Электроны поступают от молекул NAD*H и FAD"H и переносятся по дыхательной цепи. Высвобождаемая энергия используется для транспорта протонов к внешней мембране митохондрий, а возникающий электрохимический градиент - для синтеза АТФ с помощью комплекса V дыхательной цепи митохондрий
44. Последовательность и строение переносчиков электронов в дыхательной цепи
1 комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН (флавинмононуклеотид), 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа.
Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию).
Восстановление ФАД в окислительно-восстановительных реакциях.
Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q.
46. Биохимические механизмы разобщения окисления и фосфорилирования факторы их вызывающие Разобщение дыхания и фосфорилирования
Некоторые химические вещества (протонофоры) могут переносить протоны или другие ионы (ионофоры) из межмембранного пространства через мембрану в матрикс, минуя протонные каналы АТФ-синтазы. В результате этого исчезает электрохимический потенциал и прекращается синтез АТФ. Это явление называют разобщением дыхания и фосфорилирования. В результате разобщения количество АТФ снижается, а АДФ увеличивается. В этом случае скорость окисления NADH и FADH2возрастает, возрастает и количество поглощённого кислорода, но энергия выделяется в виде теплоты, и коэффициент Р/О резко снижается. Как правило, разобщители - липофильные вещества, легко проходящие через липидный слой мембраны. Одно из таких веществ - 2,4-динитрофенол (рис. 6-17), легко переходящий из ионизированной формы в неионизированную, присоединяя протон в межмембранном пространстве и перенося его в матрикс.
Примерами разобщителей могут быть также некоторые лекарства, например дикумарол - антикоагулянт (см. раздел 14) или метаболиты, которые образуются в организме, билирубин - продукт катаболизма тема (см. раздел 13), тироксин - гормон щитовидной железы (см. раздел 11). Все эти вещества проявляют разобщающее действие только при их высокой концентрации.
Выключение фосфорилирования по исчерпании АДФ либо неорганического фосфата сопровождается торможением дыхания (эффект дыхательного контроля). Большое число повреждающих митохондриальную мембрану воздействий нарушает сопряжение между окислением и фосфорилированием, разрешая идти переносу электронов и в отсутствие синтеза АТФ (эффект разобщения)
1. Суммарный выход:
Для синтеза 1 молекулы АТФ необходимо 3 протона.
2. Ингибиторы окислительного фосфорилирования:
Ингибиторы блокируют V комплекс:
Олигомицин - блокируют протонные каналы АТФ-синтазы.
Атрактилозид, циклофиллин - блокируют транслоказы.
3. Разобщители окислительного фосфорилирования:
Разобщители - липофильные вещества, которые способны принимать протоны и переносить их через внутреннюю мембрану митохондрий минуя V комплекс(его протонный канал). Разобщители:
Естественные - продукты перекисного окисления липидов, жирных кислот с длинной цепью; большие дозы тиреоидных гормонов.
Искусственные - динитрофенол, эфир, производные витамина К, анестетики.
Комплексы дыхательной цепи
- Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинона на два водорастворимых цитохрома с, расположенных на внутренней мембранемитохондрии. Убихинон передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону. При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
NADPH + NAD+ ↔ NADP+ + NADH.
FeS -железно-серные центры.
ПОСМОТРЕТЬ ЕЩЕ:
. Дыхательная электронтранспортная цепь
Дыхательная электронтранспортная цепь (ЭТЦ, ETC,) - система структурно и функционально связанных трансмембран-ных белков и переносчиков электронов. ЭТЦ позволяет запасти энергию, выделяющуюся в ходе окисления НАД∙Н и ФАДН2 молекулярным кислородом (в случае аэробного дыхания) или иными веществами (в случае анаэробного) в форме трансмембранного протонного потенциала за счёт по-следовательного переноса электрона по цепи, сопряжённого с перекачкой протонов через мембрану. Компоненты дыхательной цепи. Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-пе-реносчики - убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитрат-ному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов. Ком-плексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками. К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена. Электроны поступают в дыхательную цепь различ-ными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см.
Цепь переноса электронов (цпэ).
с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический уби-гидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образу-ется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с об-разованным комплексами I, III и IV протонным градиентом. Орга-низация дыхательной цепи. Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны. Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление - самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ (ATP). Полу-ченный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство (см. с. 214), откуда через порины проникает в цитоплазму
Комплексы дыхательной цепи
- Комплекс I (НАДН дегидрогеназа) окисляетНАД-Н, отбирая у него два электрона и перенося их на растворимый в липидах убихинон, который внутри мембраныдиффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 2 протона и 2электрона из матрикса в межмембранное пространство митохондрии.
- Комплекс II (Сукцинат дегидрогеназа) не перекачивает протоны, но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината.
- Комплекс III (Цитохром bc1 комплекс) переносит электроны с убихинона на два водорастворимых цитохрома с, расположенных на внутренней мембранемитохондрии. Убихинон передаёт 2 электрона, а цитохромы за один цикл переносят по одному электрону.
Цепь переноса электронов митохондрий
При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
- Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди.
Кислород, поступающий в митохондрии из крови, связывается с атомом железа в геме цитохрома a3 в форме молекулы O2. Каждый из атомов кислорода присоединяет по два электрона и двапротона и превращается в молекулу воды.
Субстрат, образованный в цикле Кребса, подвергается дегидрированию (отщеплению водорода), в результате чего выделяется энергия, идущая на образование АТФ, а образовавшиеся в процессе электроны и протоны соединяются с кислородом и образуют воду. Восстановление молекулы О2 происходит в результате переноса 4 электронов. При каждом присоединении к кислороду 2 электронов, поступающих к нему по цепи переносчиков, из матрикса поглощаются 2 протона, в результате чего образуется молекула Н2О.
Электроны передаются по цепи переносчиков, которые находятся в самой мембране. Переносчики, принимая электроны, окисляются, а отдавая следующему, переносчику восстанавливаются. В конце ЦПЭ, электроны переходят на кислород.
Протоны вытесняются за пределы мембраны митохондрии.
Вытеснение протонов происходит за счет энергии движения электронов внутри мембраны.
Протоны не могут самопроизвольно вернуться назад в мембрану, поэтому на внешней ее стороне накапливается положительный заряд.
Протоны в конце ЦПЭ, снова проходят внутрь через специальный белок- АТФ-синтетазу (5-й фактор) и участвуют в образовании воды. При прохождении протона через АТФ-синтетазу, выделяется энергия, которая идет на синтез АТФ.
В результате ОВР реакций переносчиков из АДФ и неорганического фосфата образуется АТФ.
Важно: Без присутствия АДФ окисления не происходит!
Субстраты NAD- и NADР-зависимых дегидрогеназ находятся в матриксе митохондрий и в цитозоле.
Основные переносчики электронов встроены во внутреннюю мембрану митохондрий и организованы в 4 комплекса, расположенных в определённой последовательности (векторно). В этой последовательности их стандартные окислительно-восстановительные потенциалы становятся более положительными по мере приближения к кислороду
1.Субстрат сначала окисляется дегидрогеназой- NAD+, в результате кофермент NAD+ принимает протон и переходит в NADН.
Большинство дегидрогеназ, поставляющих электроны в ЦПЭ, содержат NAD+. Они катализируют реакции типа:
R-CHOH-R1 + NAD+ ↔ R-CO-R1 + NADH + H+.
NADРН не является непосредственным донором электронов в ЦПЭ, а используется почти
исключительно в восстановительных биосинтезах. Однако возможно включение электронов с NADPH в ЦПЭ благодаря действию пиридиннуклеотид трансгидрогеназы, катализирующей реакцию:
NADPH + NAD+ ↔ NADP+ + NADH.
Флавиновые дегидрогеназы содержат в качестве коферментов FAD или FMN.
FAD служит акцептором электронов от многих субстратов в реакциях типа:
R-CH2-CH2-R1 + E (FAD) ↔ R-CH=CH-R1 + E (FADH2),
где Е — белковая часть фермента.
Большинство FAD-зависимых дегидрогеназ — растворимые белки, локализованные в матриксе митохондрий. Исключение составляет сукци-натдегидрогеназа, находящаяся во внутренней мембране митохондрий
Или субстрат окисляется дегидрогеназой- FAD+, в результате чего кофермент FAD принимает протон и становится FADН2.
Если окисляется сукцинат (янтарная кислота), то окисление идет сукцинатдегидрогеназой сразу по FAD+.
FAD передает Коферменту Q (убихинон) электроны через FES.
Важно: убихинон не является белком. Все остальные переносчики- белки!
FeS -железно-серные центры.
Предыдущая12345678910111213Следующая
ПОСМОТРЕТЬ ЕЩЕ:
В целом работа дыхательной цепи заключается в следующем:
Дыхательная цепь переноса электронов
Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
2. Электроны движутся по ферментам дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу.
6. При этом они теряют энергию, которая используется для синтеза АТФ.
Общий принцип окислительного фосфорилирования
Восстановленные формы НАД и ФАД окисляются ферментами дыхательной цепи, благодаря этому происходит присоединение фосфата к АДФ, т.е. фосфорилирование . Поэтому весь процесс целиком получил название окислительное фосфорилирование .
Дыхательная цепь
Всего цепь переноса электронов включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.

Блок-схема дыхательной цепи

Переносчики электронов
1. Цитохромы с1, c, a, a3 (простетическая группа – гем) располагаются в различных участках дыхательной цепи, цитохром с – подвижный водорастворимый белок, перемещается по внешней стороне мембраны между 3 и 4-ым комплексами. Цитохромы aa3 содержат гем А. Он содержит вместо метильной (-СНз) и винильной (-СН=СН2) групп формильную (-СОН) группу и углеводородную цепь соответственно. Вто-рая особенность — наличие ионов меди в специальных белковых центрах.
Сu+ <-> Сu2+ + e и Fe2+ <-> Fe3+ + e
2. Железо-серные белки (FeS) – негемовые белки, функционируют совместно с флавиновыми ферментами (1, 2, 3-й комплексы) 

3. FMN (комплекс 1): FMN + NADH + H+ ———FMNH2 + NAD+
(NAD+ + 2e + 2H+ ————- NADH + H+)
KoQ (убихинон) – небелковый переносчик, комплекс 3.
Длинный гидрофобный «хвост» изопрена обеспечивает подвижность убихинона в липидном бислое.
KoQ и цитохром с – мобильные, все остальные – интегральные белки.



Строение ферментативных комплексов дыхательной цепи
Комплекс. НАДН-КоQ-редуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа , содержит 1ФМН, 6 железосерных белков.
1. NADH + H+ + FMN ———2e + 2H+——— NAD+ + FMNH2
2. FMNH2 ————2e——— Fex Sx (Fe2+ <-> Fe3+ + e)
3. Fex Sx ————2e——— KoQ
Функция
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4Н+ на наружную поверхность внутренней митохондриальной мембраны.
У эукариот - на внутренней мембране митохондрий . Переносчики расположены по своему окислительно-восстановительному потенциалу , транспорт электрона на всём протяжении цепи протекает самопроизвольно.
Протонный потенциал преобразуется АТФ-синтазой в энергию химических связей АТФ . Сопряжённая работа ЭТЦ и АТФ-синтазы носит название окислительного фосфорилирования .
Цепь переноса электронов митохондрий
- Комплекс I (НАДН-дегидрогеназный комплекс) окисляет НАД-Н , отбирая у него два электрона и перенося их на растворимый в липидах убихинон , который внутри мембраны диффундирует к комплексу III. Вместе с этим, комплекс I перекачивает 2 протона и 2 электрона из матрикса в межмембранное пространство митохондрии .
- Комплекс II (Сукцинатдегидрогеназа) не перекачивает протоны , но обеспечивает вход в цепь дополнительных электронов за счёт окисления сукцината .
- Комплекс III (Цитохром-bc 1 -комплекс) переносит электроны с убихинона на два водорастворимых цитохрома с , расположенных на внутренней мембране митохондрии . Убихинон передаёт 2 электрона , а цитохромы за один цикл переносят по одному электрону . При этом туда также переходят 2 протона убихинона и перекачиваются комплексом.
- Комплекс IV (Цитохром c оксидаза) катализирует перенос 4 электронов с 4 молекул цитохрома на O 2 и перекачивает при этом 4 протона в межмембранное пространство. Комплекс состоит из цитохромов a и a3, которые, помимо гема , содержат ионы меди .
Влияние окислительного потенциала
| Восстановитель | Окислитель | Ео´, В |
|---|---|---|
| Н2 | 2 + | - 0,42 |
| НАД Н + Н+ | НАД + | - 0,32 |
| НАДФ Н + Н+ | НАДФ + | - 0,32 |
| Флавопротеин (восстановл.) | Флавопротеин (окисл.) | - 0,12 |
| Кофермент Q Н2 | Кофермент Q | + 0,04 |
| Цитохром B (Fe2+) | Цитохром B (Fe3+) | + 0,07 |
| Цитохром C 1 (Fe2+) | Цитохром C 1 (Fe3+) | + 0,23 |
| Цитохромы A (Fe2+) | Цитохромы A(Fe3+) | + 0,29 |
| Цитохромы A3 (Fe2+) | Цитохромы A3 (Fe3+) | +0,55 |
| H2O | ½ О2 | + 0,82 |
Ингибиторы дыхательной цепи
Некоторые вещества блокируют перенос электронов через комплексы I, II, III, IV .
- Ингибиторы I комплекса - барбитураты , ротенон , пиерицидин
- Ингибитор II комплекса - малонат .
- Ингибитор III комплекса - антимицин А , миксотиазол , стигматтелин
- Ингибиторы IV комплекса - сероводород , цианиды , угарный газ , оксид азота, азид натрия
Электронтранспортные цепи бактерий
Бактерии, в отличие от митохондрий, используют большой набор доноров и акцепторов электронов, а также разные пути переноса электрона между ними. Эти пути могут осуществляться одновременно, например, E. coli при выращивании на среде, содержащей глюкозу в качестве основного источника органического вещества, использует две НАДН дегидрогеназы и две хинолоксидазы, что означает наличие 4 путей транспорта электрона. Большинство ферментов ЭТЦ индуцибельны и синтезируются только в случае, если путь, в который они входят, востребован.
Донором электрона помимо органического вещества у бактерий могут выступать молекулярный водород , угарный газ , аммоний , нитрит , сера , сульфид , двухвалентное железо . Вместо НАДН и сукцинатдегидрогеназы могут присутствовать формиат -, лактат -, глицеральдегид-3-фосфатдегидрогеназа, гидрогеназа и т. д. Вместо оксидазы, использующейся в аэробных условиях, в отсутствие кислорода бактерии могут использовать редуктазы, восстанавливающие различные конечные акцепторы электрона: фумаратредуктазу , нитрат- и нитритредуктазу и т. д.
См. также
Напишите отзыв о статье "Дыхательная цепь переноса электронов"
Примечания
Отрывок, характеризующий Дыхательная цепь переноса электронов
Наконец-то всё вокруг пришло в движение, и вся эта великолепно разодетая толпа, как по мановению волшебной палочки, разделилась на две части, образуя ровно посередине очень широкий, «бальный» проход. А по этому проходу медленно двигалась совершенно потрясающая женщина... Вернее, двигалась пара, но мужчина рядом с ней был таким простодушным и невзрачным, что, несмотря на его великолепную одежду, весь его облик просто стушёвывался рядом с его потрясающей партнёршей.Красавица дама была похожа на весну – её голубое платье было сплошь вышито причудливыми райскими птицами и изумительными, серебристо-розовыми цветами, а целые гирлянды настоящих живых цветов хрупким розовым облачком покоились на её шелковистых, замысловато уложенных, пепельных волосах. Множество ниток нежного жемчуга обвивали её длинную шею, и буквально светились, оттенённые необычайной белизной её изумительной кожи. Огромные сверкающие голубые глаза приветливо смотрели на окружающих её людей. Она счастливо улыбалась и была потрясающе красивой....
Французская королева Мария-Антуанетта
Тут же, стоящий от всех в стороне, Аксель буквально преобразился!.. Скучающий молодой человек куда-то, в мгновение ока, исчез, а вместо него... стояло живое воплощение самых прекрасных на земле чувств, которое пылающим взглядом буквально «пожирало» приближающуюся к нему красавицу даму...
– О-о-ой... какая же она краси-ивая!.. – восторженно выдохнула Стелла. – Она всегда такая красивая!..
– А что, ты её видела много раз? – заинтересованно спросила я.
– О да! Я хожу смотреть на неё очень часто. Она, как весна, правда же?
– И ты её знаешь?.. Знаешь, кто она?
– Конечно же!.. Она очень несчастная королева, – чуть погрустнела малышка.
– Почему же несчастная? По мне так очень даже счастливая, – удивилась я.
– Это только сейчас... А потом она умрёт... Очень страшно умрёт – ей отрубят голову... Но это я смотреть не люблю, – печально прошептала Стелла.
Тем временем красавица дама поравнялась с нашим молодым Акселем и, увидев его, от неожиданности на мгновение застыла, а потом, очаровательно покраснев, очень мило ему улыбнулась. Почему-то у меня было такое впечатление, что вокруг этих двоих людей мир на мгновение застыл... Как будто на какой-то очень короткий миг для них не существовало ничего и никого вокруг, кроме них двоих... Но вот дама двинулась дальше, и волшебный миг распался на тысячи коротеньких мгновений, которые сплелись между этими двумя людьми в крепкую сверкающую нить, чтобы не отпускать их уже никогда...
Аксель стоял совершенно оглушённый и, опять никого не замечая вокруг, провожал взглядом свою прекрасную даму, а его покорённое сердце медленно уходило вместе с ней... Он не замечал, какими взглядами смотрели на него проходящие молодые красавицы, и не отвечал на их сияющие, зовущие улыбки.
Граф Аксель Ферсен Мария-Антуанетта
Человеком Аксель и в правду был, как говорится, «и внутри, и снаружи» очень привлекательным. Он был высоким и изящным, с огромными серьёзными серыми глазами, всегда любезным, сдержанным и скромным, чем одинаково привлекал, как женщин, так и мужчин. Его правильное, серьёзное лицо редко озарялось улыбкой, но если уж это случалось, то в такой момент Аксель становился просто неотразим... Поэтому, было совершенно естественным усиленное к нему внимание очаровательной женской половины, но, к их общему сожалению, Акселя интересовало только лишь одно на всём белом свете существо – его неотразимая, прекрасная королева...
– А они будут вместе? – не выдержала я. – Они оба такие красивые!..
Стелла только грустно улыбнулась, и сразу же «окунула» нас в следующий «эпизод» этой необычной, и чем-то очень трогательной истории...
Мы очутились в очень уютном, благоухающем цветами, маленьком летнем саду. Вокруг, сколько охватывал взгляд, зеленел великолепно ухоженный, украшенный множеством статуй, роскошный парк, а вдалеке виднелся ошеломляюще огромный, похожий на маленький город, каменный дворец. И среди всего этого «грандиозного», немного давящего, окружающего величия, лишь этот, полностью защищённый от постороннего взгляда сад, создавал ощущение настоящего уюта и какой-то тёплой, «домашней» красоты...
Усиленные теплом летнего вечера, в воздухе витали головокружительно-сладкие запахи цветущих акаций, роз и чего-то ещё, что я никак не могла определить. Над чистой поверхностью маленького пруда, как в зеркале, отражались огромные чашечки нежно-розовых водяных лилий, и снежно-белые «шубы» ленивых, уже готовых ко сну, царственных лебедей. По маленькой, узенькой тропинке, вокруг пруда гуляла красивая молодая пара. Где-то вдали слышалась музыка, колокольчиками переливался весёлый женский смех, звучали радостные голоса множества людей, и только для этих двоих мир остановился именно здесь, в этом маленьком уголке земли, где в этот миг только для них звучали нежные голоса птиц; только для них шелестел в лепестках роз шаловливый, лёгкий ветерок; и только для них на какой-то миг услужливо остановилось время, давая возможность им побыть вдвоём – просто мужчиной и женщиной, которые пришли сюда, чтобы проститься, даже не зная, не будет ли это навсегда...
Дама была прелестной и какой-то «воздушной» в своём скромном, белом, вышитом мелкими зелёными цветочками, летнем платье. Её чудесные пепельные волосы были схвачены сзади зелёной лентой, что делало её похожей на прелестную лесную фею. Она выглядела настолько юной, чистой и скромной, что я не сразу узнала в ней ту величественную и блистательную красавицу королеву, которую видела всего лишь несколько минут назад во всей её великолепной «парадной» красоте.
Следующий этап биологического окисления служит превращению энергии, запасенной в НАДН и ФАДН2 в процессе гликолиза и цикла трикарбоновых кислот в энергию высокоэнергетических связей молекул АТФ . В ходе этого процесса электроны от НАДН и ФАДН2 перемещаются по многоступенчатой цепи переноса электронов к конечному их акцептору - молекулярному кислороду . Это - цепь процессов окисления-восстановления. При переходе электрона со ступени на ступень в определенных звеньях такой цепи освобождающаяся энергия служит для фосфорилирования АДФ в АТФ. Поскольку в этом процессе окисление сопряжено с фосфорилированием, то его называют окислительным фосфорилированием. Окислительное фосфорилирование открыл в 1931 г. выдающийся русский биохимик В.А. Энгельгардт . В цепь переноса электронов, которая расположена на внутренней мембране митохондрий , входит ряд последовательно расположенных переносчиков электронов, которые отличаются способностью акцептировать электроны. Самый сильный акцептор электронов кислород расположен в конце цепи.
Среди промежуточных переносчиков электронов - кофермент Q , цитохром b , цитохром ci , цитохром с , цитохром а , цитохром а3 и, наконец, О2 . Кофермент Q, или убихинон, представляет собой производное бензохинона, способное при участии фермента принимать электроны окисляемого НАДН и передавать их на восстанавливаемый цитохром b. Промежуточным переносчиком электронов является фермент, в состав которого входит акцептор электронов - флавинмононуклеотид , сокращенно ФМН . При переносе электрона с ФМН на кофермент Q происходит первое фосфорилирование АДФ в АТФ. Еще две молекулы АТФ синтезируются на последующих этапах, где акцепторами электронов служат цитохромы. Цитохромы b, ci, с, а и а3 представляют собой белки, к которым присоединены молекулы гема железо-порфирина, подобные тем, которые содержатся в составе гемоглобина эритроцитов или хлорофилла, магнийпорфирина. Ниже ( рис. стр 82) схематически изображена цепь переноса электрона с участками, в которых происходит фосфорилирование АДФ в АТФ. В комплексе цитохром а и а3, который называют цитохромоксидазой , помимо атомов железа содержатся атомы меди. Атомы железа и меди в этих молекулах и служат попеременно акцепторами и донорами электронов. Как энергия, запасенная в НАДН и ФАДН2, служит синтезу АТФ? Атомы водорода этих восстановленных соединений транспортируются в мембраны митохондрий, где они оставляют электроны е- на внутренней стороне мембраны, а катионы Н+ переносятся на наружную сторону. Электроны соединяются с кислородом, в результате чего образуются анионы:
О2 + е- = О2- Между наружной поверхностью мембраны, где накапливаются катионы Н+ , и внутренней, где накапливаются анионы O2- возникает разность потенциалов. В мембраны митохондрий встроены молекулы фермента, синтезирующего АТФ . Когда разность потенциалов достигает определенной величины, катионы начинают двигаться через каналы в молекуле фермента, и их энергия расходуется на синтез АТФ. Внутри митохондрий катионы Н + , соединяясь с анионами О2 -образуют воду. Таким образом, электроны восстановленных НАДН и ФАДН2 в процессе
Переносчики электронов в дыхательной цепи организованы в надмолекулярные комплексы (табл.3).
Таблица 3
Комплексы митохондриальной цепи переноса электронов
Примечание: цитохром с не входит в состав комплекса; цитохром с является растворимым белком и перемещается между комплексами III и IV.
Комплекс I (НАДН-дегидрогеназа) катализирует перенос электронов от НАДН к коферменту Q (КоQ).
1. Комплекс представляет собой фермент, состоящий из 42 полипептидных цепей, связан с внутренней мембраной митохондрии и пересекает ее поперечном направлении.
2. Простетическими группами являются ФМН-содержащий флавопротеин и шесть FeS-центров.
3. Комплекс I катализирует 2 сопряженных процесса: 1) экзергонический транспорт к убихинону гидрид-иона от НАДН и протона из матрикса (НАДН + Н + + Q → НАД + + QН 2) и 2) эндергонический перенос 4-х протонов из матрикса в межмембранное пространство.
4. Комплекс I катализирует перенос гидрид-иона от НАДН к ФМН, от которого 2 e¯ движутся через ряд FeS-центров к FeS-белку N-2 в матриксной части комплекса. От N-2 электроны переносятся к убихинону на мембранной части комплекса с образованием QН 2 .
5. Движение протонов в межмембранное пространство приводит к образованию электрохимического потенциала на внутренней мембране митохондрий, который накапливает энергию, высвобождаемую при переносе электронов. При этом наружная сторона мембраны, обращенная к межмембранному пространству, заряжается положительно, а внутренняя сторона, обращенная к матриксу, отрицательно.
6. Суммарное уравнение реакции, которое показывает локализацию протонов можно записать следующим образом:
НАДН + 5 Н + N + Q → НАД + + QH 2 + 4H + P , где N (negative) – отрицательно заряженная сторона мембраны (матрикс), P (positive) – положительно заряженная сторона внутренней мембраны митохондрий (межмембранное пространство)
7. Убихинол (QH 2) диффундирует во внутренней мембране митохондрий от комплекса I к комплексу III, где окисляется до Q.
Комплекс II (сукцинатдегидрогеназа):
1. Сукцинатдегидрогеназа (комплекс II) является интегральным белком, связанным с внутренней мембраной митохондрий и окисляет сукцинат (янтарную кислоту из ЦТК).
2. Простетические группы: ФАД, FeS-центры с четырьмя атомами Fe. Электроны транспортируются от сукцината (промежуточный продукт ЦТК) к ФАД, затем через FeS-центры к убихинону. Выталкивания протонов в межмембранное пространство не происходит, поскольку изменение свободной энергии незначительно.
3. Другие субстраты для митохондриальных дегидрогеназ отдают электроны в дыхательную цепь на уровне убихинона, но не через комплекс II (рис. 9.4).
4. Ацил-КоА (активная форма жирной кислоты) окисляется ФАД-зависимой дегидрогеназой (ацил-КоА-дегидрогеназой ), которая передает электроны на электронтранспортный флавопротеин (ЭТФ), ЭТФ:убихинол оксидоредуктазу и в дыхательную цепь на убихинон.
5. Глицерол-3-фосфат, образующийся при распаде триацилглицеролов или восстановлении диоксиацетонфосфата при гликолизе, окисляется ферментом глицерол-3-фосфатдегидрогеназой , который локализован на наружной стороне внутренней мембраны митохондрий и передает электроны в дыхательную цепь на убихинон.
6. QH 2 , образующийся в результате этих реакций, окисляется комплексом III.
Комплекс III (цитохром bc 1 комплекс, убихинон:цитохром с-оксидоредуктаза) переносит электроны от восстановленного кофермента Q (убихинола) к цитохрому с , который является водорастворимой молекулой и локализован в межмембранном пространстве, и одновременно транспортирует протоны из матрикса в межмембранное пространство. Убихинол-цитохром с -редуктаза содержит 2 типа цитохромов b и c и Fe-S белки.
Механизм переноса электронов в комплексе можно представить следующим образом:
Комплекс IV (цитохром с-оксидаза, цитохромоксидаза) катализирует перенос электронов от цитохрома с к молекулярному кислороду, как конечному акцептору. Для полного восстановление кислорода до Н 2 О необходимо 4 электрона и 4Н + .
4 цит с (восстановл.) + 4 Н + + О 2 → 4 цит с (окислен.) + 2 Н 2 О
Комплекс IV представляет собой большой фермент (13 субъединиц, м.м. 204 000 Да) внутренней мембраны митохондрий. Известно, что 3 субъединицы кодируются митохондриальной ДНК. Содержит две молекулы гема а и а 3 и два иона меди (Cu A и Cu B), которые принимают электрон и восстанавливаются (Cu 2+ ↔ Cu 1+).
Электроны передаются: цитохром с → Cu A → Fe гема а → Fe гема а 3 - Cu B . Гем а 3 вместе с атомом меди Cu B образует «бинуклеарный центр», с которым связывается кислород. Кислород остается связанным между планарной структурой гема а 3 и Cu B до полного восстановления. Это препятствует образованию токсичных свободных радикалов.
Для каждых 4-х электронов, проходящих через комплекс, фермент использует 4 «субстратных» Н + из матрикса (N сторона), превращая кислород в Н 2 О. Энергия восстановительной реакции используется для выталкивания в межмембранное пространство (Р сторона) одного Н + на каждый транспортируемый электрон.
Суммарное уравнение, катализируемое комплексом IV можно представить следующим образом:
4 цит с (восстановл.) + 8 Н + N + О 2 → 4 цит с (окислен.) + 4H + P + 2 Н 2 О
K 6-й координационной связи железа цитохрома а может присоединиться HCN, H 2 S, CO. При этом валентность железа (Fe 3+) становится постоянной и поток электронов прекращается. Это механизм действия дыхательных ядов.
Похожая информация.